Accueil > Équipes scientifiques > Structure et dynamique des systèmes complexes isolés photoexcités (SYSIPHE) > CHIralité et spectroscoPIE (CHIPIE) > Rôle de l’énergie de déformation dans la formation des complexes
Rôle de l’énergie de déformation dans la formation des complexes
par - 26 mars 2010 (modifié le 25 mars 2020)
Nous avons pu montrer que contre toute attente, il existe des systèmes pour lesquels ceci n’est plus vrai. Lors de notre étude du complexe o-cyanophénol/m-cyanophénol, nous avions montré que le complexe était formé entre le conformère cis du m-cyanophénol et le conformère trans de l’o-cyanophénol alors que ce dernier n’est pas le conformère le plus stable. Dans le même temps, les études de la complexation du napthyléthanol avec les amino alcools ont montré que nous n’obtenions pas le complexe calculé comme étant le plus stable de tous mais que nous obtenions des minima secondaires de la surface d’énergie potentielle.
Plus récemment, nous avons pu mettre en évidence que ceci était du à une compétition entre processus de refroidissement cinétique et thermodynamique. Nous avons introduit la notion d’énergie de déformation (Edef) qui correspond à l’énergie nécessaire pour déformer les molécules afin de former le complexe. Et nous avons montré que cette énergie était une image de la barrière à la formation des complexes.
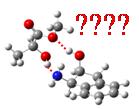
L’exemple du système (1R,2S)-(+)-cis-1-amino-2-indanol et methyl lactate peut être considéré comme un cas d’école. Les structures présentées ci-dessous représentent les différentes familles de complexes obtenus. Nous avons montré que nous n’observions pas le complexe tête bêche bien qu’il soit le plus stable de tous les complexes calculés et que nous formions les complexes insertion et addition . Il s’avère que pour former ce complexe, les deux molécules doivent subir une déformation importante puisqu’il y a ouverture des liaisons hydrogènes intramoléculaires de chacune d’entre elle pour former deux liaisons hydrogènes intermoléculaires. De fait, en l’état actuel de nos recherches nous pensons que la valeur de 2kcal/mol est une valeur limite haute pour dire qu’un complexe ne pourra être formé.

- Famille de structures calculées pour les complexes (1R,2S)-(+)-cis-1-amino-2-indanol et methyl lactate
Publications
Chiral recognition in jet-cooled complexes of (1R,2S)-(+)-cis-1-amino-2-indanol and methyl lactate : on the importance of the CH⋯π interaction
K. Le Barbu-Debus, M. Broquier, A. Mahjoub, and A. Zehnacker-Rentien
Phys. Chem. Chem. Phys., 2009, vol 11, 7589-7598
Chiral Recognition between α-Hydroxylesters : A Double-Resonance IR/UV Study of the Complexes of Methyl Mandelate with Methyl Glycolate and Methyl Lactate
K. Le Barbu-Debus, M. Broquier, A. Mahjoub and A. Zehnacker-Rentien
J. Phys. Chem. A, 2008, vol 112 (40), pp 9731–9741
Localization of electronic and vibrational energy in the jet-cooled m-cyanophenol/o-cyanophenol dimer : laser induced fluorescence and fluorescence-dip IR spectra
K. Le Barbu-Debus , M. Broquier , F. Lahmani & A. Zehnacker-Rentien
Molecular Physics : An International Journal at the Interface Between Chemistry and Physics, 2005, vol 103 (11-12), Pages 1655-1662
The role of chirality in the competition between inter and intramolecular hydrogen bonds : jet-cooled van der Waals complexes of (±)2-naphthyl-1-ethanol with (±)1-amino-2-propanol and (±)2-amino-1-butanol
N. Seurre, J. Sepioł, K. Le Barbu-Debus, F. Lahmania and A. Zehnacker-Rentien
Phys. Chem. Chem. Phys., 2004, vol 6, 2867-2877
Dans la même rubrique :
- Philosophie de nos études
- Dichroïsme circulaire vibrationnel (VCD)
- Dichroïsme circulaire de photoélectron (PECD)
- Spectroscopie de dipeptides cycliques
- Le rôle des liaisons faibles
- Influence de la chiralité sur la structure de polyphénylalanines
- Reconnaissance moléculaire dans les dérivés de la quinine
- Technique et développement expérimentaux
- Activités en posters
- Collaborations


