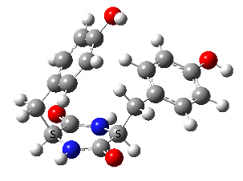
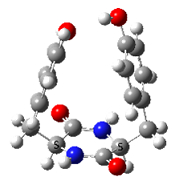
Accueil > Équipes scientifiques > Structure et dynamique des systèmes complexes isolés photoexcités (SYSIPHE) > CHIralité et spectroscoPIE (CHIPIE) > Spectroscopie de dipeptides cycliques
Spectroscopie de dipeptides cycliques
par - 3 août 2018 (modifié le 18 mars 2020)
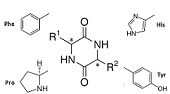
En revanche, la structure du cyclo tyrosine-tyrosine, cyclo Tyr-Tyr, dépend beaucoup de la chiralité des résidus. La structure "repliée-étendue" observée pour cyclo Phe-Phe est aussi observée pour les deux diastéréo-isomères de cyclo Tyr-Tyr (LL et LD) (figure de gauche). Mais une structure impliquant une liaison hydrogène entre les hydroxyles des deux résidus tyrosine est observée uniquement pour le cyclo Tyr-Tyr de chiralité LL (figure de droite)
|
|
L’étude du cyclo Tyrosine-Proline, cyclo Tyr-Pro, montre que sa structure présente peu de différences en fonction de la chiralité des résidus. Néanmoins, deux familles de conformères présentes en phase gazeuse ont été identifiées. Dans la plus stable, le cycle aromatique de la tyrosine est replié au-dessus du cycle peptidique avec une interaction de type CH…π. Cette interaction CH…π n’est pas tout à fait la même dans cyclo-L-Tyr-L-Pro et L-Tyr-D-Pro. Dans la deuxième famille, appelée "étendue", le cycle de la tyrosine est tourné vers l’extérieur de la molécule comme le montrent les images du bas ci-dessous. Cette famille est stabilisée par la présence d’interaction de type NH…π.
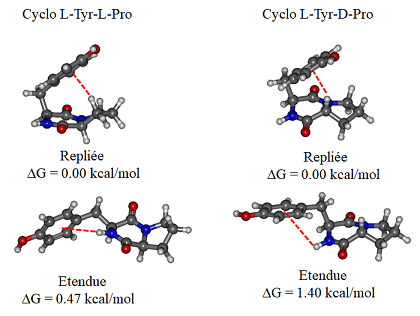
- Familles de structures du cyclo Tyr-Pro, LL à gauche et LD à droite
Publications
Conformational Study of the Jet-Cooled Diketopiperazine Peptide Cyclo Tyrosyl-Prolyl
A. Pérez-Mellor, I. Alata, V. Lepere, and A. Zehnacker
Journal of Physical Chemistry B, 2019, vol 123 (28), 6023-6033
Stereochemistry-dependent hydrogen bonds stabilise stacked conformations in jet-cooled cyclic dipeptides : (LD) vs. (LL) cyclo tyrosine–tyrosine
F. BenNasr, A. Pérez-Mellor, I. Alata, V. Lepere, N.-E. Jaïdane, and A. Zehnacker
Faraday Discussions, 2018, vol 212, 399-419
Chirality effects in the structures of jet-cooled bichromophoric dipeptides
A. Pérez-Mellor, I. Alata, V. Lepere, and A. Zehnacker
Journal of Molecular Spectroscopy, 2018, vol 349, 71-84
Vibrational circular dichroism of a 2,5‐diketopiperazine (DKP) peptide : Evidence for dimer formation in cyclo LL or LD diphenylalanine in the solid state
A. Pérez‐Mellor, and A. Zehnacker
Chirality, 2017, vol 29 (2), 89–96.
Dans la même rubrique :
- Philosophie de nos études
- Dichroïsme circulaire vibrationnel (VCD)
- Dichroïsme circulaire de photoélectron (PECD)
- Le rôle des liaisons faibles
- Influence de la chiralité sur la structure de polyphénylalanines
- Reconnaissance moléculaire dans les dérivés de la quinine
- Rôle de l’énergie de déformation dans la formation des complexes
- Technique et développement expérimentaux
- Activités en posters
- Collaborations